Увидеть каждый атом: за что дали Нобелевку по химии
В школе все науки понятно и привычно делили сферы влияния. В домашних заданиях явления требовали отнести либо к физическим, либо к химическим. В реальной жизни это уже давно не так, и Нобелевская премия по химии 2017 года — очередное тому доказательство. На престижнейшую научную награду для химиков номинированы трое учёных, работающих в сфере биологии и открывших способ, как увидеть структуру отдельных биомолекул в их естественной среде обитания — водном растворе.
Оглавление
При чём тут химия?
Уже не первый год Нобелевскую премию по химии присуждают за биологические открытия. И на этот раз Ричард Хендерсон, Иоахим Франк и Жак Дубоше были номинированы на Нобелевку за "развитие криоэлектронной микроскопии высокого разрешения для определения структуры биомолекул в растворе". Неужели в науке о превращениях веществ за последние десятилетия не случилось ничего прорывного? А если случилось, то почему с химиками обходятся так несправедливо?
На самом деле несправедливости тут нет. Современная наука мультидисциплинарна. Каждый уважающий себя исследователь подходит к интересующей его проблеме с самых разных сторон, используя солидный набор методов для её изучения. Теперь уже недостаточно провести какую-нибудь одну химическую реакцию или вывести линию мух с определённым геном. Статью об исследовании, в котором использованы один-два метода, приличный научный журнал не примет. Необходимо использовать и физические, и химические, и биологические подходы к одному и тому же вопросу. В конце концов, всё живое состоит из молекул, традиционных объектов изучения химии, а эти молекулы и их группы подчиняются физическим законам.
К тому же наука о жизни давно уже ушла от препарирования лягушек и наблюдения за цветением растений. Многие современные биологи в ходе работы ни разу не сталкиваются с живыми объектами. Огромные силы брошены на фронт биоинформатики — анализа последовательностей нуклеотидов ДНК и аминокислот в белках с использованием компьютерных алгоритмов. Классической биологии в этом, прямо скажем, нет. Для биоинформатических изысканий не нужны ни пробирки, ни микроскопы, ни другие предметы, на фоне которых журналисты и телевизионщики обычно снимают учёных.
Но есть и те, кто стоит к живому чуть ближе. Они работают не с целыми организмами и даже не с конкретными органами, а с отдельными биологическими молекулами. Кстати, эти молекулы не такие уж и мелкие. Как правило, они состоят из сотен тысяч атомов — особенно если говорить о белках и нуклеиновых кислотах. Способов соединить эти атомы великое множество, а ведь от них зависят форма и поведение молекулы. Ферменты — биологические катализаторы — потому и помогают проводить биохимические реакции, что способны менять форму своих молекул.
Как увидеть отдельную молекулу?

Фото: © REUTERS/Toby Melville
Конечно, молекулы белков и нуклеиновых кислот крупнее, чем какой-нибудь глюкозы. Но всё же они недостаточно большие, чтобы их было видно в обычный, световой микроскоп. Его разрешение ограничено длиной световой волны, падающей на исследуемый объект. Как правило, она составляет не более 250 нанометров. Соответственно, все объекты размером меньше 250 нанометров в световой микроскоп видны не будут.
Обойти эту проблему в 1930-х годах позволили электронные микроскопы. В них на исследуемый объект не светит солнце или лампочка — на него обрушивается поток электронов. В остальном принцип работы электронного микроскопа похож на принцип самого простого светового микроскопа, но длина волны электронов существенно короче длины волны видимого света. Поэтому теоретическое разрешение электронной микроскопии в теории позволяет различать чуть ли не отдельные атомы.
Есть способы увидеть структуру молекул и без использования электронного микроскопа. Это рентгеноструктурный анализ и спектроскопия ядерно-магнитного резонанса (ЯМР). Но ЯМР-спектроскопия, к сожалению, подходит только для сравнительно небольших белков, а более крупные, в сотни тысяч аминокислот длиной, она "не берёт". Рентгеноструктурный анализ требует, чтобы молекулы находились в форме кристаллов. С этим есть трудности, так как далеко не все белки просто кристаллизовать. Ко всему прочему, когда биомолекулы находятся в кристаллической форме и/или в вакууме, как это часто бывает при электронной микроскопии, их свойства могут заметно отличаться от тех, что проявляются в натуральных условиях. А "натуральные условия" в данном случае — это водный раствор, потому что живые организмы по большей части состоят из воды.
Стекло и пачки фотографий

Фото: © flickr/BASF — We create chemistry
С водой в электронном микроскопе проблемы. Её не должно там быть, потому что между источником электронов и исследуемым образцом необходимо поддерживать вакуум. Если электроны будут "натыкаться" на препятствия до встречи с образцом, картинка получится зашумлённой. В воздушной атмосфере электроны пролетят всего несколько сантиметров, прежде чем полностью рассеяться.
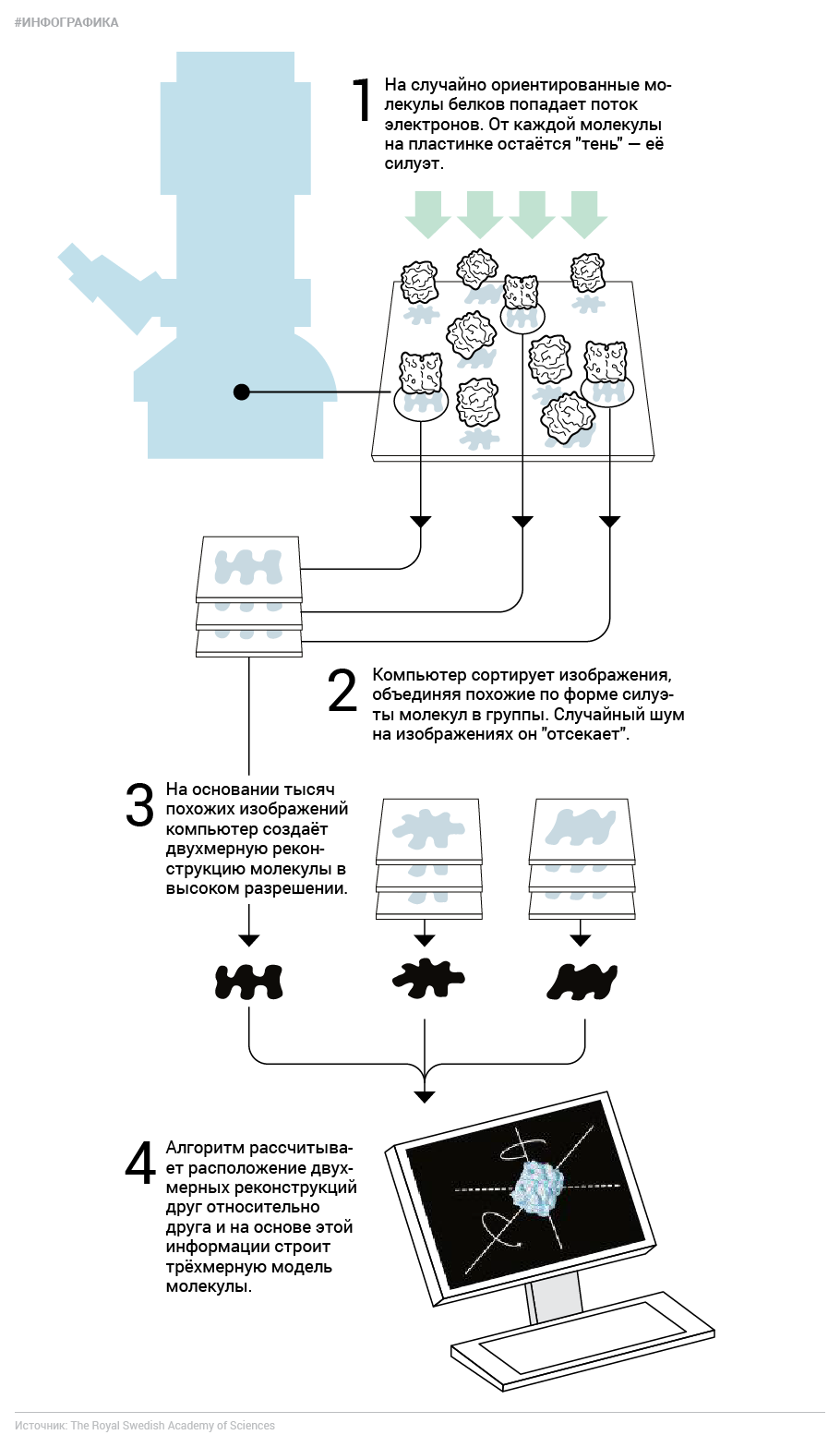
Один из сегодняшних нобелевских лауреатов, швейцарский биофизик Жак Дубоше, придумал способ обойти эту проблему и при этом сохранить исследуемые молекулы в том виде, в котором они "плавают" в водном растворе цитоплазмы клеток. С помощью жидкого этана и азота он сильно охлаждал воду, окружающую образцы, так быстро, что она приобретала свойства стекла — витрифицировалась. Витрифицированная твёрдая вода по свойствам отличается ото льда. Её молекулы не выстраиваются в характерные для льда кристаллические решётки, а остаются практически на тех же местах, что и в момент начала охлаждения. Благодаря этому растворённые в такой воде молекулы "застывают" с той же структурой, какую они имеют и в живых клетках. На них точно так же, как и при "обычной" электронной микроскопии, могут налетать электроны, и "тени" от них будут всё так же видны. Фактически Дубоше добавил "крио-" (что значит "заморозка") к электронной микроскопии.
Казалось бы, все проблемы на этом закончились. Мы сохранили белок в первозданном виде, вот мы получили его "отпечаток", чего же ещё? Проблема в том, что крупные молекулы трёхмерны и при этом имеют очень сложную форму, а отдельные изображения проекций содержат очень много шума. Стало быть, по одной-единственной проекции белка его строение не вычислишь даже близко. Нужно много "фотографий" одинаковых молекул, сделанных с разных сторон, чтобы создать двухмерную реконструкцию. Первым задачу реконструкции трёхмерной структуры из двухмерной проекции решил Аарон Клуг ещё в 1962-м на примере симметричного хвоста бактериофага, за что в 1982 году получил Нобелевскую премию по химии.
А новоиспечённый лауреат Иоахим Франк, американский биофизик немецкого происхождения, разработал вычислительные принципы для реконструкции частиц с любой симметрией. Он создал алгоритмы, позволяющие вычленить изображение исследуемой молекулы из общей картины, и научил компьютер сортировать такие изображения по степени их сходства, чтобы из отдельных шумных проекций создать виды молекулы с разных сторон. Затем Франк и другие его коллеги придумали, как комбинировать эти двухмерные виды, чтобы создавать трёхмерные реконструкции. До недавних пор эта была нетривиальная задача, и её решение зависело от конкретного образца. Сейчас улучшенное ПО и высокие вычислительные мощности позволяют решить эту задачу гораздо проще.
Красивые картинки и не только
Методами, разработанными Дубоше и Франком, воспользовался шотландец Ричард Хендерсон и добавил к ним кое-что своё. Именно он в 1990 году выпустил статью, в которой продемонстрировал структуру пурпурного белка бактериородопсина в достаточно высоком разрешении. Однако не надо думать, что он пришёл на всё готовое. Бактериородопсином Хендерсон занимался уже задолго до развития криоэлектронной микроскопии и первый раз попытался установить строение этого белка в 1975 году. Тогда это казалось невозможным: молекула "в оригинале" была встроена в мембрану бактериальной клетки, да и кристаллизоваться никак не хотела. Тем не менее кое-какие детали структуры бактериородопсина ему удалось узнать уже тогда.
С тех пор Хендерсон и его коллеги вот уже более 40 лет уточняют структуры отдельных биологических молекул. Во многом благодаря его стараниям в 2013 году начался бум в области криоэлектронной микроскопии: были выпущены новые детекторы и программное обеспечение для реконструкций. Тогда же впервые была получена структура мембранного канала с атомарным разрешением. Говоря проще, в изучаемой молекуле можно было разглядеть каждый атом. После этого начался настоящий бум криоэлектронной микроскопии, и работ с использованием этого метода публикуют всё больше.
The final technical hurdle was overcome in 2013, when a new type of electron detector came into use. pic.twitter.com/Ue9c0R6v7y
— The Nobel Prize (@NobelPrize) 4 октября 2017 г.
В чём прелесть структур биомолекул, полученных таким образом, кроме их красоты и подробности? Как мы уже говорили выше, тонкое строение молекул надо знать, чтобы представлять себе их физические и химические свойства. Это важно в первую очередь для современной фармакологии. Известно, что очень близкие по строению вещества могут оказывать кардинально разное действие на организм из-за какого-нибудь небольшого различия в расположении нескольких атомов в их молекулах. Активность белков сильно разнится в зависимости от их конформации. А ведь сейчас всё большее количество лекарств от рака и прочих тяжёлых заболеваний представляют собой именно белки.
Криоэлектронная микроскопия также позволяет прояснить механизмы действия уже существующих лекарств. Можно сделать раствор препарата и того вещества, на которое он действует, витрифицировать этот раствор и посмотреть, как выглядят молекулы в нём. Скорее всего, лекарство и его мишень сольются в одну молекулу, и важно знать, какими частями они будут соприкасаться и как изменится форма каждого из участников тандема. Если витрифицировать несколько таких идентичных смесей в разное время, можно отследить этапы взаимодействия одной молекулы с другой.
Метод позволяет изучать не только отдельные молекулы, но и структуры покрупнее — например, вирусы. Учитывая недавние эпидемии лихорадки Эбола и лихорадки Зика, возбудители которых именно вирусы, знать их строение критически важно, чтобы понимать, какими лекарствами с ними бороться. Это верно и для ВИЧ, который хоть и громко заявил о себе на десятилетия раньше, но до сих пор угрожает нам. Так что у специалистов по криоэлектронной микроскопии впереди ещё много работы на благо человечества.
Atomic structures of a) protein complex that governs circadian rhythm b) pressure sensor of the type that allows us to hear c) Zika virus pic.twitter.com/ixAyJesj99
— The Nobel Prize (@NobelPrize) 4 октября 2017 г.
